★CHIMIE★
Les liaisons chimiques :
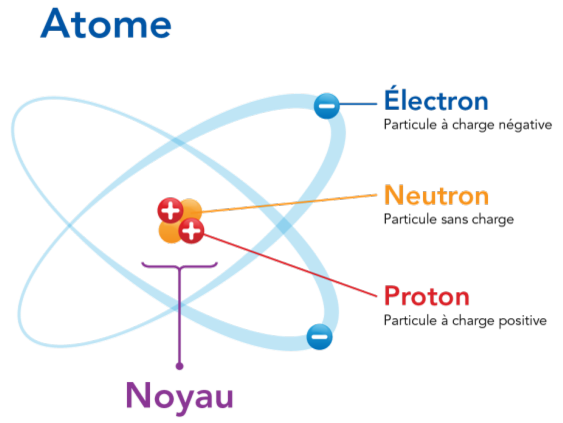
Structure de l'atome :
Le modèle de Lewis :
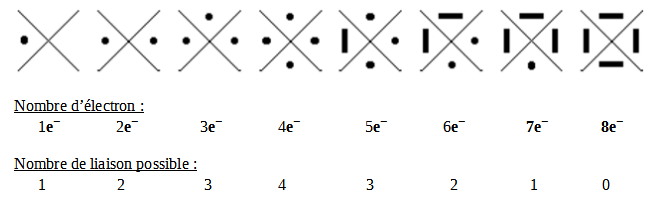
● = Un électron célibataire
━ = Une paire d'électron, un doublet
Dans le tableau periodique, nous pouvons voir au-dessus des 8 familles leur modèle de Lewis représentée par leurs couches de valences.
Les liaisons chimiques : Ioniques et covalentes
La règle de l'octet : Règle empirique, basée sur l'observation.
→ Avoir 8 électrons sur la couche de valence rend la substance stable. Ce sont les gaz rares.
Par conséquent, toute substance avec moins de 8 électrons de valence va avoir tendance à se lier avec d'autre substance afin de se rapprocher le plus possible d'un gaz rare.
La différence d'électronégativité :
Certains atomes sont plus électronégatifs que d'autres (voir tableau periodique). Donc quand deux atomes vont se rapprocher, il y a 3 cas de figure :
-
La liaison est covalente :
- Parfaite (Apolaire)
- Polarisée
- Parfaite (Apolaire)
- **La liaison est ionique**
△X = │XA - XB│