★CHIMIE★
Les liaisons chimiques :
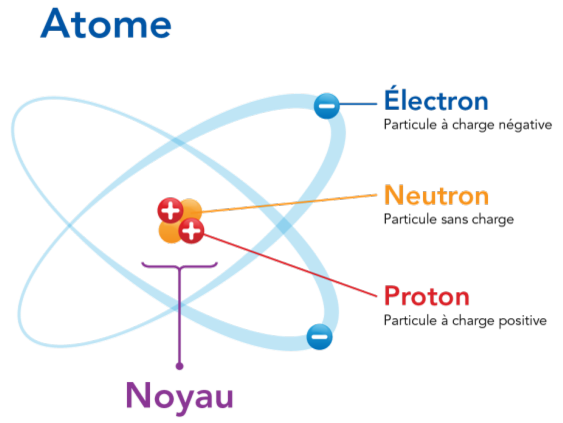
Structure de l'atome :
Le modèle de Lewis :
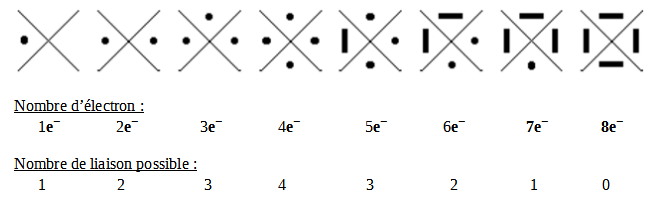
● = Un électron célibataire
━ = Une paire d'électron, un doublet
Dans le tableau periodique, nous pouvons voir au-dessus des 8huit familles leur modèle de Lewis représentée par leurs couches de valences.
Les liaisons chimiques : Ioniques et covalentes
La règle de l'octet : Règle empirique, basée sur l'observation.
→ Avoir 8 électrons sur la couche de valence rend la substance stable. Ce sont les gaz rares.
Par conséquent, toute substance avec moins de 8 électrons de valence va avoir tendance à se lier avec d'autre substance afin de se rapprocher le plus possible d'un gaz rare.
La différence d'électronégativité :
Certains atomes sont plus électronégatifs que d'autres (voir tableau periodique). Donc quand deux atomes vont se rapprocher, il y a 3 cas de figure :
-
La liaison est covalente :
- Parfaite (Apolaire)
- Polarisée
- Parfaite (Apolaire)
- **La liaison est ionique**
△X = │XA - XB│
X = électronégativité (Voir tableau periodique)

Les liaisons covalentes parfaites/apolaire : Ce sont des liaisons qui résultent de la mise en commun de deux électrons célibataires entre deux atomes de même électronégativité.
△X = 0
EX : H2, Cl2, PH3, SO3
Les liaisons covalentes polarisées : C'est la mise en commun de deux électrons célibataires d'électronégativité différentes comprise entre 0 et 1,7.
L'atome le plus électronégatif à une charge partielle négative (δ-) et l'atome qui est le moins électronégatif à une charge partielle positive (δ+).
EX : HCl
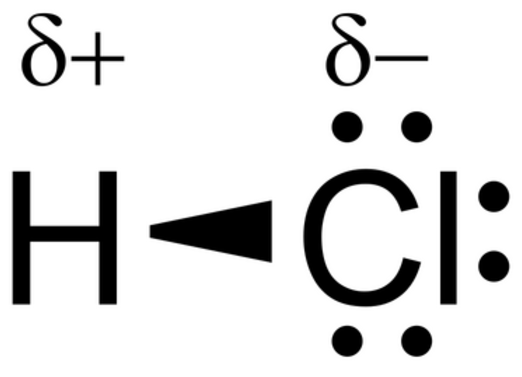
Les liaisons ioniques :
C'est la liaison entre deux atomes de charges opposées.
En général, c'est entre du métal (qui donne un électron) et un non-métal (qui reçoit l'électron).
Cela va former un anion (ion portant une charge électrique négative) et un cation (ions portant une charge électrique positive).
EX : NaCl
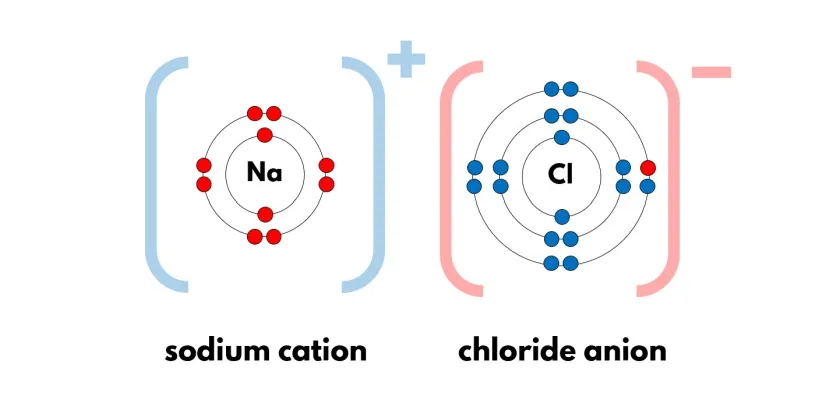
Les différences entre les liaisons ioniques et les liaisons covalentes :
La liaison ionique : Un atome cède un électron à un autre.
→ il y a un métal et un non-métal
C'est très polaire, la différence d'électronégativité est de plus de 1,7
La liaison covalente : 2 atomes partagent un électron.
→ Il y a deux non-métaux
C'est peu polaire, la différence d'électronégativité est de moins de 1,7
Les molécules polaires ou les dipôles électriques :