★CHIMIE★
Les liaisons chimiques :
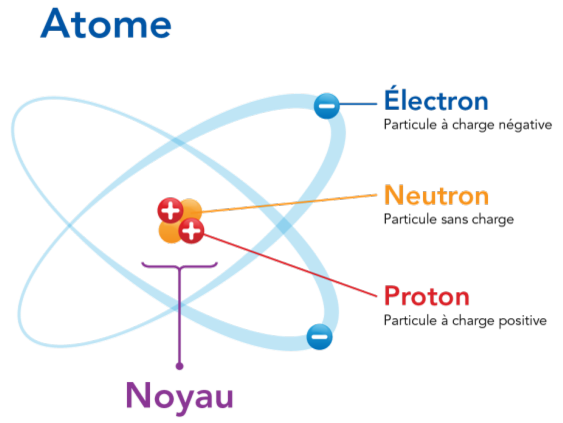
Structure de l'atome :
Le modèle de Lewis :
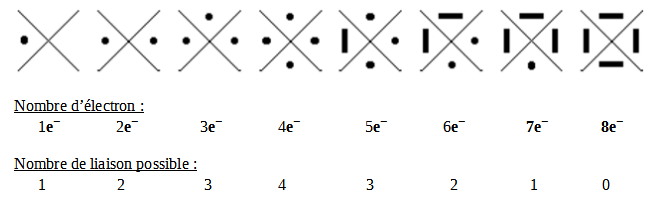
● = Un électron célibataire
━ = Une paire d'électron, un doublet
Dans le tableau periodique, nous pouvons voir au-dessus des huit familles leur modèle de Lewis représentée par leurs couches de valences.
Les liaisons chimiques : Ioniques et covalentes
La règle de l'octet : Règle empirique, basée sur l'observation.
→ Avoir 8 électrons sur la couche de valence rend la substance stable. Ce sont les gaz rares.
Par conséquent, toute substance avec moins de 8 électrons de valence va avoir tendance à se lier avec d'autre substance afin de se rapprocher le plus possible d'un gaz rare.
La différence d'électronégativité :
Certains atomes sont plus électronégatifs que d'autres (voir tableau periodique). Donc quand deux atomes vont se rapprocher, il y a 3 cas de figure :
-
La liaison est covalente :
- Parfaite (Apolaire)
- Polarisée
- Parfaite (Apolaire)
- **La liaison est ionique**
△X = │XA - XB│
X = électronégativité (Voir tableau periodique)

Les liaisons covalentes parfaites/apolaire : Ce sont des liaisons qui résultent de la mise en commun de deux électrons célibataires entre deux atomes de même électronégativité.
△X = 0
EX : H2, Cl2, PH3, SO3
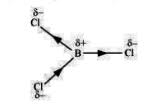
Les liaisons covalentes polarisées : C'est la mise en commun de deux électrons célibataires d'électronégativité différentes comprise entre 0 et 1,7.
L'atome le plus électronégatif à une charge partielle négative (δ-) et l'atome qui est le moins électronégatif à une charge partielle positive (δ+).
EX : HCl
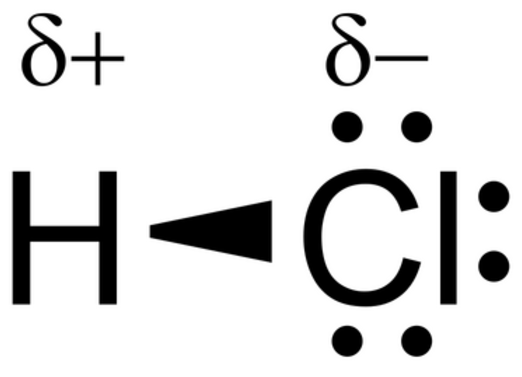
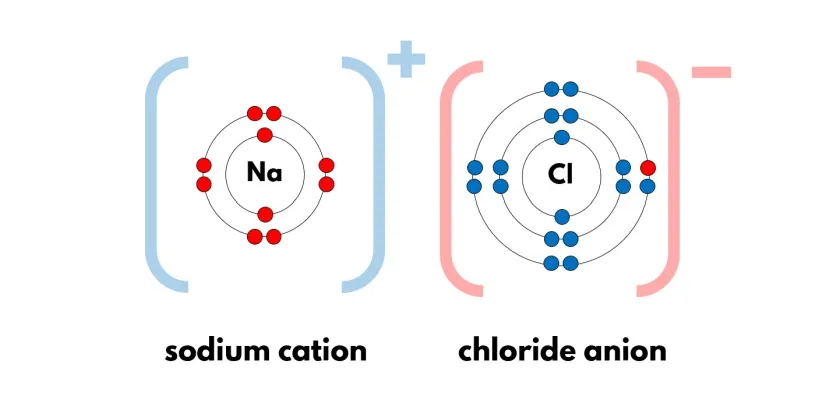
Les liaisons ioniques :
C'est la liaison entre deux atomes de charges opposées.
En général, c'est entre du métal (qui donne un électron) et un non-métal (qui reçoit l'électron).
Cela va former un anion (ion portant une charge électrique négative) et un cation (ions portant une charge électrique positive).
EX : NaCl
Les différences entre les liaisons ioniques et les liaisons covalentes :
La liaison ionique : Un atome cède un électron à un autre.
→ il y a un métal et un non-métal
C'est très polaire, la différence d'électronégativité est de plus de 1,7
La liaison covalente : 2 atomes partagent un électron.
→ Il y a deux non-métaux
C'est peu polaire, la différence d'électronégativité est de moins de 1,7
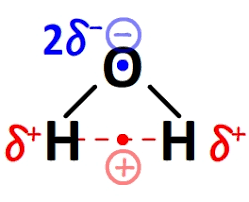
Les molécules polaires ou les dipôles électriques :
C'est une molécule qui ne partage pas uniformément les électrons à travers la liaison covalente et qui présente un dipôle sur les atomes impliqués.
Une molécule est polaire si :
- Si elle est composée d'élément ayant une électronégativité différente.
- S'il y a un dipôle, le centre des charges positives n'est pas au même endroit que le centre des charges négatives.
Les molécules apolaires :
Les molécules apolaires sont composées d'atomes qui ont une valeur d'électronégativité similaire. Lorsque deux atomes d'électronégativité semblable partagent des électrons dans une liaison covalente, ils sont attirés vers l'un ou l'autre atome de manière égale.
Une molécule est apolaire si :
-Si tous les atomes qui composent la molécule ont la même électronégativité.
ou
La configuration spatiale des molécules :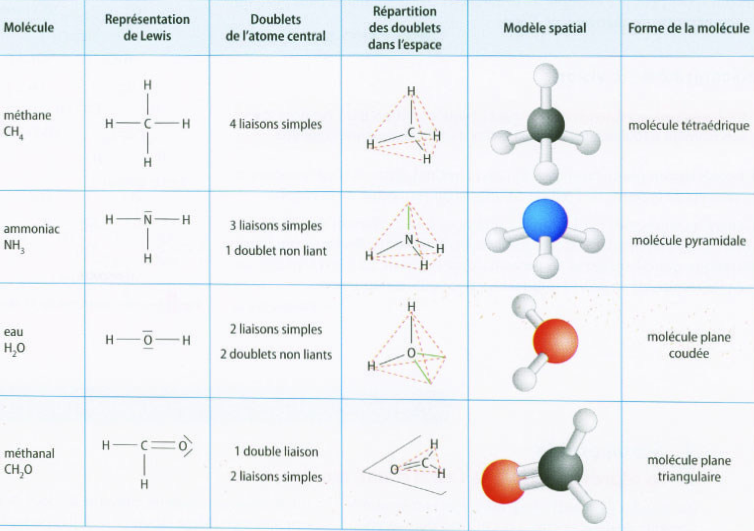
La solubilité des substances dans un laboratoire :
Les substances covalentes peuvent être : liquide, solide ou gazeux
-
Les solvants polaires : EX : de l'eau
→ Dissous bien les substances covalentes polaires
→ Dissous peu les solutés covalents apolaires
⇉ Les acides sont ionisés en solution aqueuse -
Les solvants apolaires :
→ Dissous bien les solutés covalents apolaires
→ Dissous peu les solutés covalents polaires
La solubilité des substances ioniques dans l'eau : dans un laboratoire également
Substance ionique → Solides cristallins

Les équilibres chimiques :
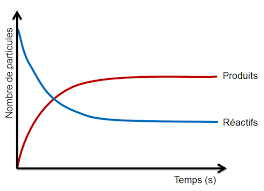
Les réactions complètes et irréversibles :
La réaction consomme au minimum complètement un des réactifs.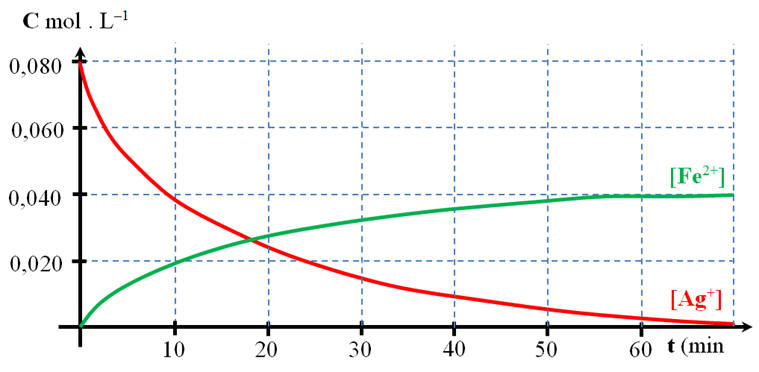
A + B → C + D
Les réactions incomplètes et réversibles :
La réaction ne consomme pas totalement ses réactifs.
A + B ⇌ C + D
L'état d'équilibre :
Une réaction complète et réversible va évoluer vers un état d'équilibre, c'est quand la concentration des réactifs n'évoluent plus.
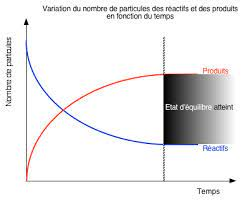
Expression de la constante d'équilibre :
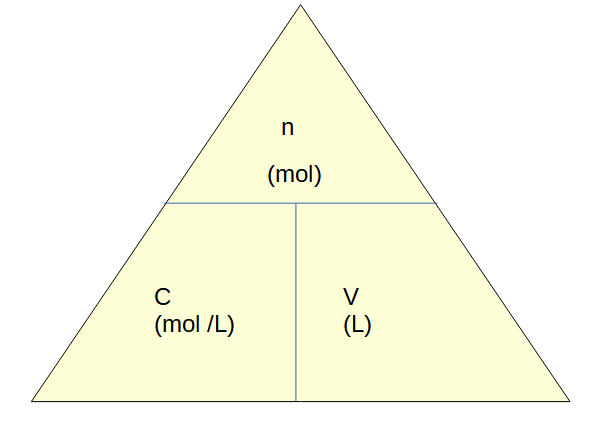
RAPPEL : La concentration molaire, C (mol/L), c'est le rapport à la quantité de matière, n (mol), et le volume, V (L).
La constante de concentration (KC)Kc) :
Cela permet d'estimer les proportions des produits formés par rapport aux réactifs à l'état d'équilibre. C'est calculé en mol/L.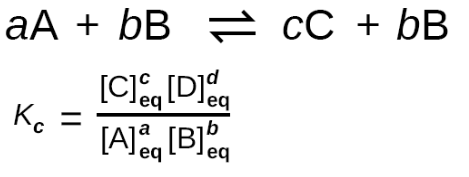
- Il dépend de la température du système
- Les composants solides n'appairassent pas
- L'équilibre peut être hétérogène ou homogène
Homogène → Tous les produits et réactif sont dans le même état
EX : Gaz, Liquide
Hétérogène → Les produits et réactifs ne sont pas dans le même état
Si le KCKc est élevé : Soit, KCKc > $1. $10^{10}$
La réaction est considérée comme complète et irréversible.
- à l'équilibre il y aura plus de produit que de réactifs
- dans l'équation, ça va aller vers la droite. La réaction va consommer presque tous les réactifs et créer que des produits
Si le Kc est faible : Soit, $Kc < 10^{-10}$
- à l'équilibre il y aura plus de réactifs que de produits
- dans l'équation, ça va aller vers la gauche. La réaction va consommer presque tous les produits et créer que des réactifs.
** Si :** $1.10{-10} ≤ Kc ≥ 1.10{10}$ La réaction est incomplète et réversible.